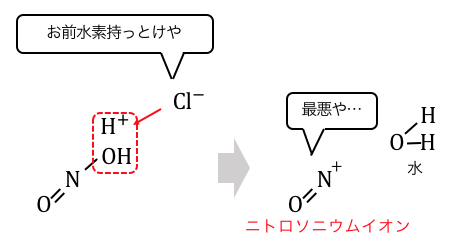
ニトロソニウムイオン (英: nitrosonium ion) は、化学式 NO と表されるオキシカチオンである。ニトロシルカチオン(nitrosyl cation)と呼ばれることもある。窒素原子と酸素原子は結合次数3で共有結合しており、全体的に正電荷を帯びている。 このイオンは CO や N2 と等電子的である。 NO は、NOClO4、NOSO4H(正確には ONOSO2OH、すなわち混合酸無水物である)、NOBF4 (英語版) のような塩として存在する。ClO4- や BF4- との塩はアセトニトリルにわずかに溶ける。NOBF4 は、200-250 °C、0.01 mmHg (1.3 Pa) で昇華によって精製することができる。
NO は酸性条件下、亜硝酸との平衡にある。ただし、亜硝酸は不安定であるため、NO を発生させる目的には通常、亜硝酸塩や亜硝酸エステルが用いられる。
- HONO H NO H2O
化学的性質
加水分解
NO は、水と直ちに反応して亜硝酸を生じる。
- NOBF4 H2O → HONO HBF4
このために、NOBF4 は水または湿った空気から保護されなければならない。塩基との反応では亜硝酸塩が生じる。
- NOBF4 2 NaOH → NaNO2 NaBF4 H2O
ジアゾ化剤
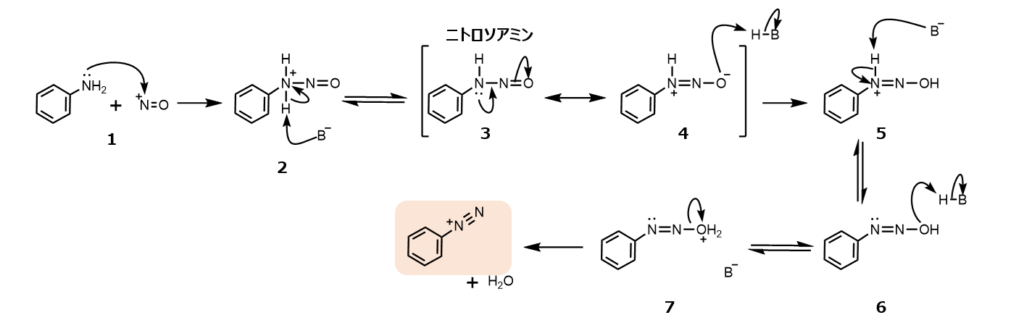
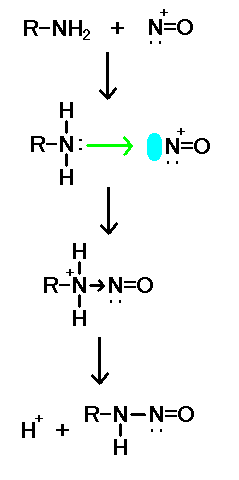
NO は、アリールアミン ArNH2 と反応してジアゾニウムイオン ArN2 を与える。結果として生じるジアゾニオ基は、アミノ基と違い、いろいろな求核剤によって容易に脱離反応を起こす。
酸化剤
NO 、例えば NOBF4 は強い酸化剤である。
- ジクロロメタン中の NO に対する Fe(Cp)2/Fe(Cp)2 系の酸化還元電位は1.00 Vである (1.46-1.48 V vs SCE)。
- アセトニトリル中の NO に対する Fe(Cp)2/Fe(Cp)2 系の酸化還元電位は0.87 Vである (1.25-1.27 V vs SCE)。
気体の副生物である NO は、反応で使用する窒素気流で取り除くことができるため、NOBF4 は便利な酸化剤である。NO は空気と接触すると直ちに NO2 となり、これが取り除かれないと余計な反応を引き起こすことがある。NO2 は、その特徴的なオレンジ色のためにすぐに発見できる。
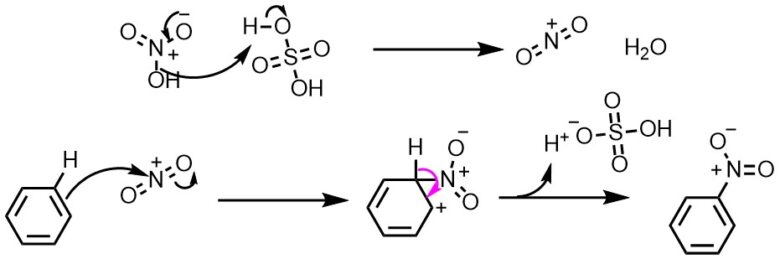
アレーンのニトロシル化
電子豊富なアレーンは、NOBF4 によってニトロシル化(ニトロソ化とも)される。例としてアニソールのニトロシル化が挙げられる。
- CH3OC6H5 NOBF4 → CH3OC6H4-4-NO HBF4
ニトロソニウムイオン NO は、ニトロ化反応の活性種であるニトロニウムイオン NO2 と混同される場合がある。しかし、これらは全く異なる化学種である。前者が弱酸(亜硝酸)、後者が強酸(硝酸)に由来するという事実によって予想されるように、NO2 は NO より強力な求電子剤である。
NO 錯体の原料
NOBF4 はいくつかの金属カルボニルと反応して、対応する金属ニトロシルを与える。NO による配位子置換反応の際は、空気による酸化に注意しなければならない。
- (C6Et6)Cr(CO)3 NOBF4 → [(C6Et6)Cr(CO)2(NO)]BF4 CO
出典
関連項目
- ニトロニウムイオン